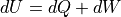熱力学の基礎¶
熱とはエネルギー,温度は状態量¶
熱の単位は「J」,温度の単位は「K / ℃」.つまり,温度はエネルギー,温度は状態量であり,両者は本質的に別なもの.
熱エネルギーQは,「物質を集団として構成する粒子が有する内部エネルギー(全エネルギー) U のうち,指向性を有する運動エネルギー(つまり仕事) K と,零点振動エネルギー U0 を除いたもの」.
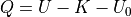
Note
統計力学 ( or プラズマ物理学 ) における分布関数を用いた運動エネルギー,及び,熱エネルギーの定義がわかりやすい.
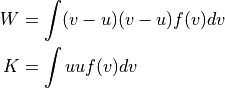
温度は,「熱エネルギーがどの程度集中しているかを表す状態量」.
温度が高い <=> 熱エネルギーが集中している.
温度が低い <=> 熱エネルギーが分散している.
熱力学第二法則¶
熱力学第二法則として,以下の表現がある( 全て等価 ).
Note
熱力学第二法則 form.1 クラウジウスの原理
低温の熱源から高温の熱源へ,正の熱を移すのに,他に何の変化も起こさないようにすることはできない.
つまり, 冷たいモノから熱を奪って熱いモノへ熱エネルギーを与えるには仕事が必要 . もしくは,冷たいモノから熱いモノへ自然に(外部からの仕事無しに),熱エネルギーが移ることは起こり得ない.
Note
熱力学第二法則 form.2 トムソン-ケルビンの法則
一つの熱源から正の熱を受け取り,これを全て仕事に変える以外に,他の何の変化も起こさないようにするサイクルは存在しない.
常温(25℃)の空気に存在する熱エネルギー(分子振動)を抜き出してきて,仕事だけをさせることはできない.
Note
熱力学第二法則 form.3 オストヴァルトの原理
ただ一つの熱源から正の熱を受け取って,働き続ける熱機関(第二種永久機関)は実現不可能である.
トムソン-ケルビンの法則と同様,一つの熱源から仕事だけを受け取って他に何の影響も与えないような( 温度 0 ℃ ( 273 K ) 状態から -273 ℃ ( 0 K ) を作り出して,その差分のエネルギーを仕事として取り出すような ) 無茶苦茶なエンジン ( 第二種永久機関 )は存在しない.
Note
熱力学第二法則 form.4 クラウジウスの不等式
n個の熱源を考えて,温度 Ti の熱源 i から熱 Qi ( 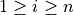 ) を受け取り,その総和分の仕事 (
) を受け取り,その総和分の仕事 ( 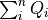 )をするサイクルを考える.この時,
)をするサイクルを考える.この時, 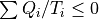 が成り立つ.
が成り立つ.
微小な熱的状態遷移でのクラウジウスの不等式 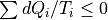 は常に成立する.
マクロに見たエントロピー増分は,
は常に成立する.
マクロに見たエントロピー増分は, 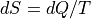 と表せるから,クラウジウスの不等式はエントロピー増大則と等価.
と表せるから,クラウジウスの不等式はエントロピー増大則と等価.
Note
熱力学第二法則 form.5 エントロピー増大則
断熱系において,不可逆変化が生じた場合,その系の エントロピーは増大する .
不可逆な変化 ( e.g. 水槽内のインクの拡散 )が置きた際には,系の乱雑度 ( エントロピー )は必ず増大する.